CD8+T细胞杀伤效应的影响因素
科学进展
2024-03-05 08:34:21
细胞毒性淋巴细胞含有能分解细胞的“颗粒”(实质为一种存储穿孔素、粒酶等“毒药”的溶酶体),释放这些颗粒可杀死靶细胞。这种胞毒性颗粒的释放通过在两个细胞(淋巴细胞和其靶细胞)的细胞膜之间建立免疫突触或称突触界面的独特结构来控制。界面结构及其形成和稳定性的动力学对颗粒输送效率起着至关重要的作用,尤其以后者更为重要。因此,作者认为,对于 CD8+ T 细胞的胞毒性而言,MHC-I 和 TCR 分子的聚集以及 CD8 与 MHC-I 的结合显著有助于CTL细胞发挥细胞毒性的效力,并认为已知抗原特异性的CD8+T细胞和工程化TCR-T细胞可能是最有效的细胞毒性细胞之一。文中,作者比较了有助于调节CD8+和CD4+细胞毒性淋巴细胞效应器功能的几个因素。

*图片来源:CellPress *
### 一、细胞毒性比较:CD4+ vs CD8+
我们知道破坏感染或癌变细胞并不是CD8+T细胞的专利,CD4+T细胞、NK细胞等淋巴细胞也能发挥溶细胞活性,但CD8+T细胞则更灵敏、更有效。本文作者早在1996年的论文中就展示,即使靶细胞上存在极少数peptide-MHC,甚至可以少至一个,也足以使CD8+T识别并破坏此细胞。
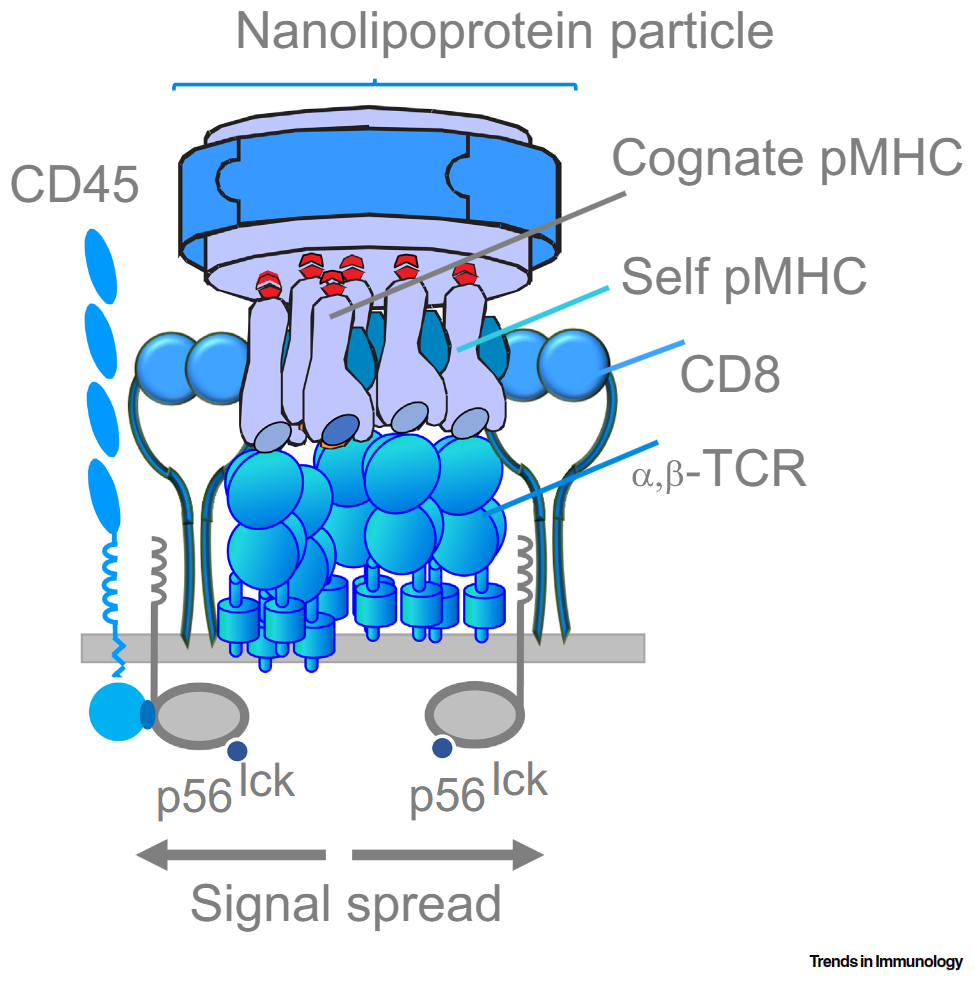
**首先,CD8分子通过与MHC-I结合对CTL的细胞毒性效应至关重要。**共受体CD4或CD8分子与pMHC-I或pMHC-II的结合,使淋巴细胞特异性酪氨酸蛋白激酶p56lck递送到TCR复合体附近(胞内侧),促进对其他含有ITAM结构域蛋白的磷酸化从而导致级联反应,引发T细胞的激活并发挥作用。通过对CD4或CD8基因敲除小鼠的研究发现,CD4共受体的缺失对于CD4-/-T细胞的功能影响相对较小,但CD8对CTL的胞毒性作用则是必不可少。与CD4+T细胞相比,CD8显著加速了CD8+CTL发挥的细胞毒性效应,并增加了快速消除异常细胞所必需的反应灵敏性,从而赢得了与后者扩增的竞争。
**其次,CD8与MHC-I的结合力比CD4与MHC-II的结合力强得多。**CD8共受体的参与也限制了TCR与pMHC-I结合的亲和力,称为“亲和力上限”,这表明CD8与MHC-I的结合消除了对更强的TCR-pMHC-I相互作用的需求。Kranz团队构建出一种比天然TCR亲和力高1000倍的肿瘤细胞特异性TCR,他们利用这种TCR基因构建工程化TCR-T细胞(包含CD8+和CD4+等亚型)并注射到小鼠,发现小鼠淋巴器官和肿瘤浸润组织中完全没有CD8+T细胞,却有表达高亲和力TCR的CD4+T细胞。由于TCR亲和力过高,其介导的信号传导过于强烈,又通过CD8与这些pMHC的结合而得到进一步增强,最终导致CD8+T细胞死亡。
**CD8+T细胞的TCR与MHC-I的结合似乎也要比CD4+T细胞的TCR与MHC-II的结合要强。**我们知道,MHC-I表达与所有有核细胞表面,而MHC-II主要表达在专业抗原提呈细胞(APC)上,如单核细胞和树突状细胞(DC)。MHC-II在这些细胞,特别是活化的APC上的表达明显高于MHC-I在靶细胞上的表达;这对于CD4+T细胞上需要大量TCR的参与才足以激活T细胞是必要的。研究表明,CD4与pMHC-II非常弱的相互作用几乎无助于由TCR与pMHC-II结合引发的CD4+T细胞效应;与CD8+CTL相比,CD4+T细胞的胞毒效应更低效,需要更长的时间来破坏相同的靶细胞。总之,与CD8+T细胞所需的TCR相比,CD4+T细胞的有效反应似乎依赖于更多TCR的参与。
### 二、毒性颗粒的释放机制
细胞毒性淋巴细胞的杀伤效果与将溶细胞颗粒递送到T细胞/靶细胞接触界面有关,这个过程受T细胞活化时胞内Ca2+离子浓度快速变化的调节。细胞内Ca2+调节动力蛋白马达的活性,使颗粒沿着微管向微管组织中心(MTOC)移动,MTOC则极化到T细胞膜与靶细胞的接触界面。随后,溶酶体膜与T细胞膜融合,将其中杀伤性物质释放到胞外。

*图片来源:CellPress *
对T细胞的强刺激信号会导致胞内Ca2+快速持续增加,而弱刺激引发Ca2+动员延迟以致T细胞效应不足。对CD8+T细胞而言,这些颗粒可在突触界面的中间区域被释放,这里没有高度多聚化的肌动蛋白,因此加速了膜融合,可能是CD8+T细胞释放这些杀伤性颗粒最有效的途径。对CD4+胞毒性T细胞而言,因为颗粒运送的路径更长,导致其在突触界面内部的释放被延迟。具体来说,因为T细胞活化时诱导的Ca2+浓度变化不够迅速,这拖慢了颗粒沿微管向MTOC的运动。颗粒被先运送到免疫突触的外周,再越过外周向中间运送。这条更长的运送路径可能导致了CD4+T细胞的细胞毒性效应比CD8+T细胞更弱。
NK细胞与靶细胞形成的免疫突触通常不如T细胞的那样有良好的组织结构,因为多聚化的肌动蛋白常常不能完全分离,颗粒只能被送到界面内部小块不含有高度多聚化肌动蛋白的区域,这可能也是它的杀伤能力比T细胞弱的原因。
**控制CD8+T细胞反应效率的另一个重要因素是T细胞上TCR分子和靶细胞上pMHC-I的聚集程度。**TCR聚集的程度取决于T细胞分化的阶段:幼稚T细胞显示出没有CD8共受体的小尺寸纳米簇,而活化的T细胞则呈现出与CD8共聚集的大尺寸的TCR分子簇。TCR与CD8共聚集增强了对只有极少甚至只有一个拷贝pMHC-I识别的能力,促进了簇内信号传导的启动。因此,紧密定位的TCR和CD8分子介导簇内的信号传播,导致TCR与自身pMHC-I结合(即不是该TCR的特异性pMHC-I),而不一定与刺激性pMHC-I结合(即是该TCR的特异性pMHC-I)。这可能是CD8+T细胞反应信号放大和灵敏度增强的机制之一。作者的团队在一种纳米颗粒的表面以不同的密度组装这种特异性pMHC-I,结果显示T细胞反应的效率与纳米颗粒上的pMHC-I的密度正相关。
因此,T细胞上抗原特异性受体的聚集程度、靶细胞上配体的聚集程度、以及CD8的共聚集状态,共同发挥着促进T细胞反应的重要作用。
### 三、工程化T细胞
T细胞上工程化TCR的表达水平可能是影响T细胞杀伤效率的重大因素。受分化阶段及其他因素的影响,每个天然T细胞上的TCR表达量在30000至100000个之间。作者的研究团队发现,用靶向黑色素瘤抗原HMM-MAA的第二代CAR转导脐带血来源的人多克隆T细胞,每个CD8+T细胞表达10000个CAR,这与转基因TCR在CD8+T细胞上表达12000个TCR相似,明显低于T细胞上内源性TCR的表达水平。
另一项研究中发现,葡萄膜黑色素瘤细胞(CM006)表面有120 000个可被CAR-T细胞识别的HMM-MAA分子,而相同细胞呈递的pMHC则少于7000个;而且这些CAR与HMM-MAA的亲和力(2×107L/M))显著高于TCR与对应pMHC的亲和力(2.4×105 L/M)。但结果却显示,CAR-T的杀伤效率不到20%,而TCR-T的为30%。
*图片来源:CellPress *
这些数据表明,启动T细胞的细胞毒性反应,需要相对较多的CAR的参与,而仅需相对少量的TCR的参与。
在同一项研究中,作者小组还比较了工程化TCR-T细胞与对相同CM006细胞有反应的“天然”CD8+T细胞,观察到天然CD8+CTL的细胞毒性效应更灵敏。因此,即使与CAR-T细胞相比,转基因TCR诱导了更灵敏的CTL反应,TCR-T细胞的反应仍然不如天然CD8+T细胞。目前尚不清楚与天然CD8+T细胞相比,较低的转基因TCR表达是否是TCR-T细胞毒性反应灵敏性较低的唯一原因。
总之,CD8共受体与MHC的结合力、TCR与pMHC的结合力、TCR在T细胞表面表达的数量、pMHC在靶细胞表面呈递的数量、T细胞内部免疫突触部位的微管形态等因素,都对T细胞的杀伤效果起到至关重要的影响。
*参考文献:1.https://pubmed.ncbi.nlm.nih.gov/37558570/---Factors contributing to the potency of CD8+T cells*

