T细胞受体(TCR)的结构和生物学特性
科学进展
2023-12-22 08:31:14
*注:文章来源于TCRshows ,作者小小富minfu,已获转载授权*
T细胞受体(TCR)与免疫球蛋白(Ig)或抗体一样,是克隆型抗原特异性受体,对免疫反应至关重要。T淋巴细胞表面的T细胞受体与免疫球蛋白有几个不同之处:①免疫球蛋白是四聚体,由四条多肽链(两条重链和两条轻链)组成,具有两个抗原识别部位;T细胞受体是二聚体,只有一个抗原识别部位(图1)。②免疫球蛋白作为B淋巴细胞上的膜结合表面受体或以分泌形式存在;T细胞受体仅作为膜结合表面受体存在。③免疫球蛋白识别可溶性抗原和天然抗原;T细胞受体一旦被处理并转化为表面小肽,并与抗原提呈细胞(如巨噬细胞、单核细胞、B细胞和树突状细胞)表面的主要组织相容性复合体(MHC)分子结合,就可以识别蛋白质抗原。这种现象被称为MHC限制性识别,或MHC限制。
T细胞识别自身MHC分子(即自身MHC)的“学习”发生在胸腺。传统的T细胞受体,或αβ TCR,表达在大多数T淋巴细胞上,由两个糖基化的多态二硫键连接链α和β(图2)组成,与非多态的膜结合CD3蛋白非共价结合,在细胞表面形成功能性的TCR-CD3。αβ TCR必须区分嵌入在MHC分子表面的不同的多肽,这些多肽的尺寸和形状相对恒定。α链和β链参与与pMHC(多肽-MHC)复合体的相互作用,而CD3蛋白参与信号转导。重组DNA技术导致在老鼠和人类中发现了另一个基因座γ。两年后,γ链被证明是另一种类型的T细胞受体的一部分,或γδ TCR,它包括两条链,γ和δ,也与CD3蛋白有关,在T细胞亚群的细胞表面(图2)。γδ TCR识别携带碳水化合物、核苷酸或磷的抗原。T细胞表达αβ TCR或γδ TCR。
αβ和γδ T细胞受体与CD3复合体(图2)有关,CD3复合体包括CD3γ、CD3δ、CD3ε、CD3ζ和CD3η蛋白,这些蛋白分别组织在CD3γε、δε和ζζ或ζη二聚体;CD4和CD8分别作为MHC II类或I类分子的辅助受体,及其伴随的T细胞特异性酪氨酸激酶p56lck;以及跨膜蛋白酪氨酸磷酸酶CD45。
在T细胞受体识别外来抗原后,T细胞被激活。它们获得CD69等激活抗原,表达包括CD25(IL-2受体α链)在内的细胞因子受体,并开始增殖。αβ和γδ T细胞都表现出两种效应功能:细胞因子的产生和对微生物和肿瘤细胞的细胞毒活性。αβ和γδ T细胞的效应细胞毒活性包括两条途径:通过颗粒酶/穿孔素途径介导的细胞毒作用和通过Fas/Fas配体相互作用介导的细胞凋亡途径。
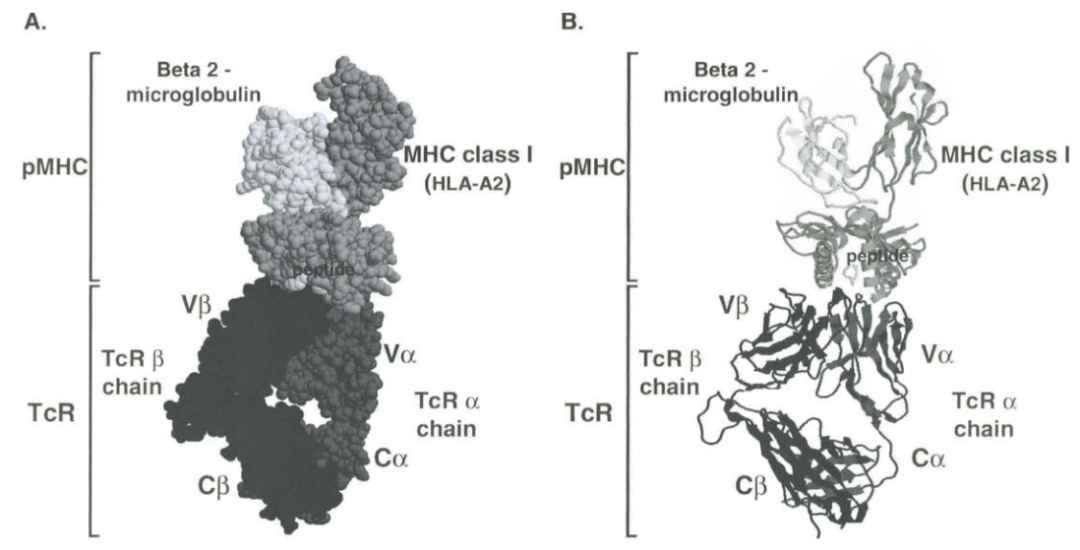
●图1 识别人类MHC I类分子HLA-A2呈递的病毒多肽的人αβ TCR的3D图。
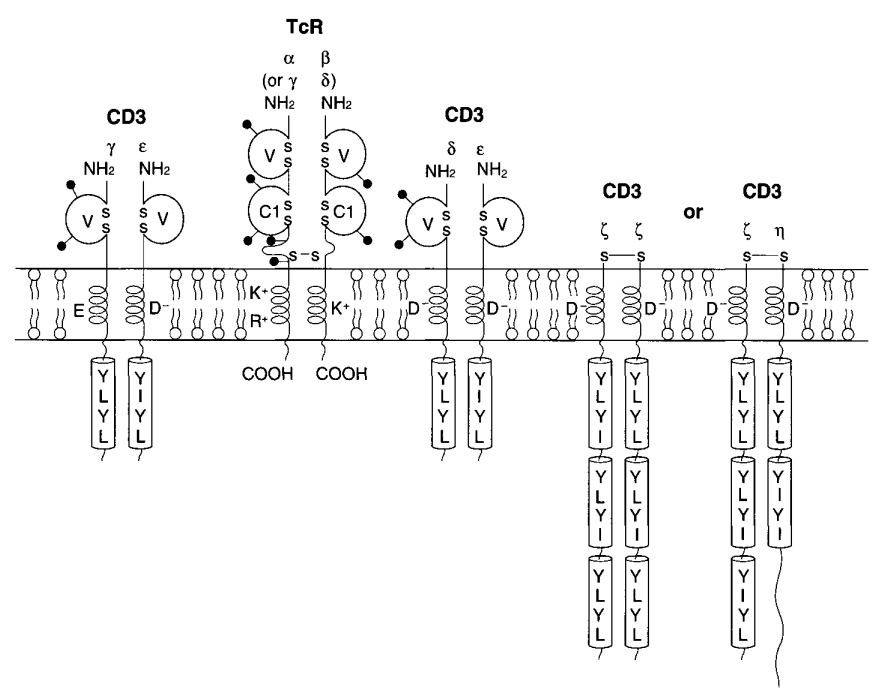
●图2 αβ(或γδ)TCR-CD3复合体。指出了跨膜区的正负电荷氨基酸以及胞质内的CD3 ITAMs。
### αβ和γδ T细胞
**αβ T细胞**
αβ TCR表达于T细胞表面,同时也表达CD抗原CD3和CD4或CD8,这些CD3+CD4+CD8-和CD3+CD4-CD8+ αβ T细胞占人类成熟外周T细胞的90%-99%。CD3+CD4+ αβ T细胞(约占αβ T细胞的60%)识别与MHC II类分子结合的多肽(通常来自微生物等外源抗原),并在大部分情况下是辅助T细胞。CD3+CD8+ αβ T细胞(约占αβ T细胞的30%)识别与MHC I类分子结合的多肽(由内源性处理产生),主要是细胞毒性T细胞,负责发现感染或癌细胞。CD4和CD8分别是与II类和I类分子的非多态区域相互作用的分子。有一小部分αβ T细胞缺乏CD4和CD8(双阴性)。这些细胞,以及一些CD8+ αβ T细胞,以CD1受限的方式识别微生物脂质抗原。
αβ T细胞识别潜在无限排列的抗原-MHC组合的能力存在于TCRα和β链的可变N端部分。APC细胞表面的单个pMHC可以顺序地结合并触发多达200个αβ TCR,这与已测量的TCR与pMHC结合的低亲和力和快速解离率一致。一个主要问题是解释TCR如何识别在APC表面发现的100000个不相关的pMHC中只有100个的特定pMHC。
TCRα和β链受到等位基因排斥的影响,因此一种独特的αβ受体类型通常在给定的T细胞克隆的表面表达。然而,在多达1/3的成熟T细胞的膜表面已发现表达两条不同的α链的αβ T细胞,因此有两种不同的αβ受体。一小部分(约1%)的人外周T细胞也表达两种不同的Vβ。
**γδ T 细胞**
γδ T细胞占人类外周T细胞的1-10%(平均为3%),占胸腺细胞的0.2-0.9%。γδ T细胞受体主要表达在表达CD3的T细胞表面,但缺乏CD4或CD8。因此,CD4-CD8- γδ T细胞(约占γδ T细胞的60%)独立于经典的MHC I类或II类分子识别抗原。存在一个亚群的CD4-CD8+ γδ T细胞(约占γδ T细胞的30%),以及一些非常罕见的CD4+CD8- γδ T细胞。CD4-CD8+ γδ T细胞通常表达CD8αα,而不是传统αβ T细胞表达的CD8αβ异源二聚体。
这γδ T细胞可以识别一系列不同的配体,例如在小鼠中,来自细菌或自体细胞的应激诱导的热休克蛋白,在人类中,应激诱导的MHC分子(MICA和MICB),以及这γδ细胞的非肽类碳水化合物、核苷酸和分枝杆菌磷携带抗原的功能可能是消除处于应激状态下的全身细胞,例如由于感染或向恶性肿瘤转化的结果。γδ T细胞受体的功能、它们的同源抗原的性质以及这些抗原被识别的背景仍然缺乏特征,是广泛研究的对象。
与α链和β链一样,γ链和δ链具有克隆性独特的结构,并受到等位基因排斥的影响。然而,已经鉴定出γδ T细胞表达两条不同的γ链,在较低的频率下,表达两条不同的增量链。
### TCR链
**TCR链的结构**
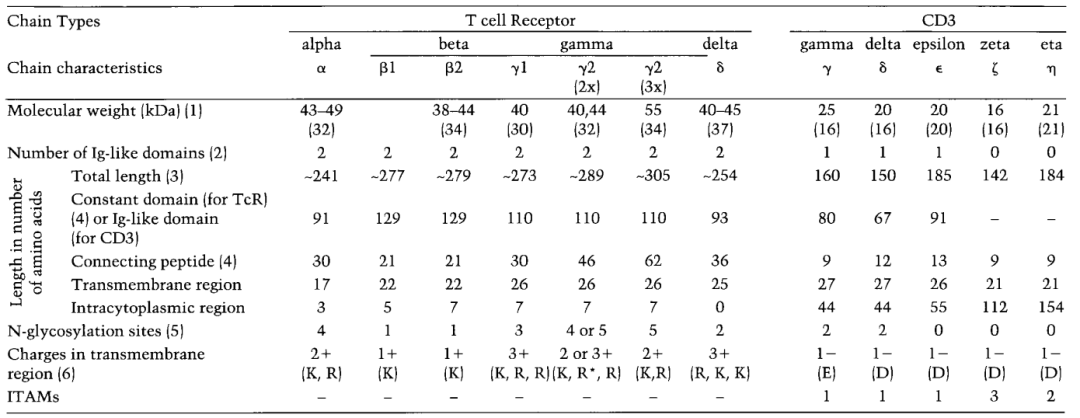
αβ TCR的α和β链,γδ TCR的γ和δ链具有N-末端胞外区,包括104-125个氨基酸的可变区和91-129个氨基酸的恒定区,21-62个氨基酸的连接肽,17-26个氨基酸的跨膜区,以及0-7个氨基酸的细胞质小尾(表1)。每个可变和恒定结构域的结构类似于免疫球蛋白结构域的结构,由一系列多链反平行的β-折叠双层和51-66个氨基酸的二硫键内环(图3)表征。这些线束来回编织,形成一个折叠的薄片,折叠成三明治状的结构。αβ TCR组分的X射线晶体结构:包括小鼠β链、Vα同源二聚体和完整的αβ TCR;人TCR、病毒多肽和人I类MHC分子之间的复合体,小鼠TCR、多肽和MHC类II之间的复合体;人Vδ结构域和小鼠TCR的复合体与抗TCR Fab链在跨膜区近端包含一个半胱氨酸,分别参与α-β和γ-δ链间二硫键的形成。由恒定基因TRGC2编码的人TCR γ2链是一个例外,因为它在该区域没有半胱氨酸,并且非二硫键连接到δ链(图4)。γ2链比γ1长16或32个氨基酸。这是由于TRGC2基因的等位基因多态性显示了外显子2的二聚[TRGC2(2x)]或三聚[TRGC2(3x)],所有克隆型α、β、γ和δ链以及相关的CD3蛋白都具有一个疏水的、可能是螺旋状的膜跨越区域,该区域具有包含带电氨基酸的不同寻常的特征:TCRα、β、γ和δ链有一个或两个正电荷,CD3蛋白有一个负电荷,这可能是为了稳定TCR-CD3复合体(图2)。
● 表1 人TCR和CD3链特征
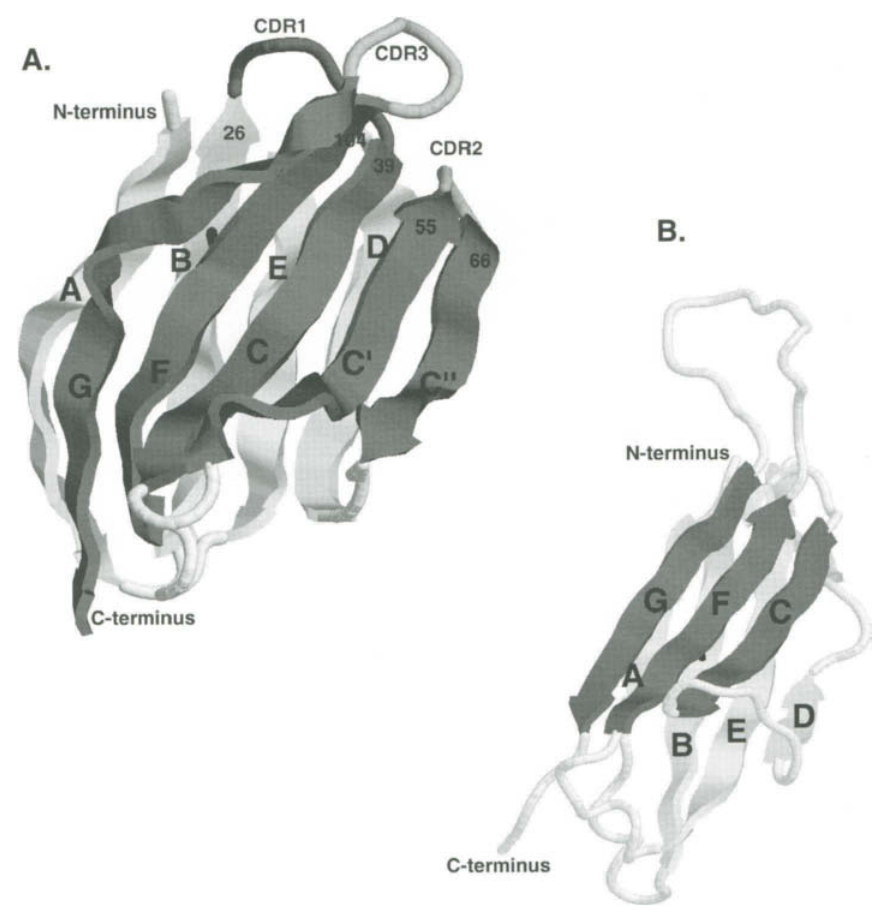
●图3 TCR β链的可变域(A)和恒定域(B)的3D图。
**TCR链的糖基化**
**T细胞受体链是糖蛋白。**人TCR α链(43-49 kDa)包含4-5个复合类型的N-连接寡糖,与32 kDa的多肽主链相连(表1)。人TCR β链(38-44 kDa)包含一个或两个(一个高甘露糖和一个复合物) N-连接聚糖侧链,连接到34 kDa的多肽骨架上。
根据恒定区有三种类型的人γ链(图4): γ1链(40 kDa),其由TRGC1基因编码的恒定区与δ链二硫键连接,并具有三个N-糖基化位点,γ2(2x)链(40 kDa和44 kDa,代表两种不同程度的糖基化),由等位基因TRGC2基因编码,具有外显子2的二聚体(比γ1长16个氨基酸);以及由等位TRGC2基因编码的γ2(3x)条链(55 kDa),外显子2为三聚体(长于γ1 32个氨基酸)。γ2(2x)和γ2(3x)链与δ链非二硫键连接,具有4或5个N-糖基化位点(表1)。外显子数量的这些变化和糖基化程度的差异解释了γ1 (40 kDa)和γ2(40 kDa或44 kDa,55 kDa)链相对分子质量的差异。因此,根据γ链的不同,有三种类型的T细胞受体γδ二聚体:二硫键连接的γ1δ受体和非二硫键连接的γ2(2x) δ和γ2(3x) δ受体(图4)。
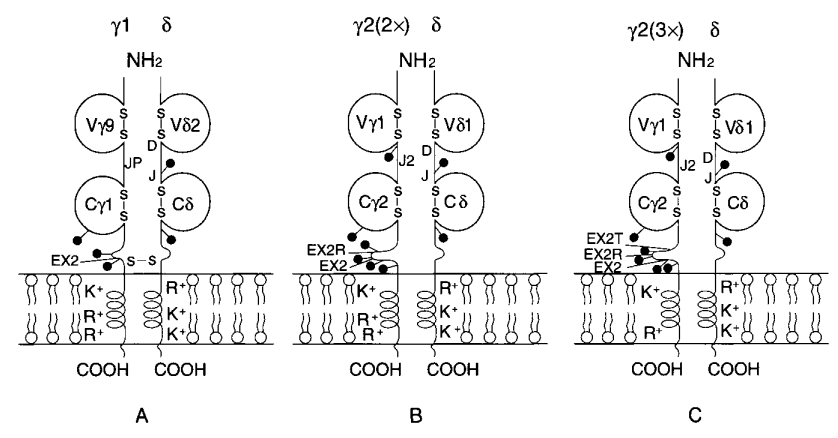
●图4 三种人γδ TCR示意图。人γδ TCR有三种类型,通过它们的γ条链来区分:(A) γ1δ TCR,其中40 kDa链二硫键连接到δ链;(B) γ2(2x) δ TCR;和(C) γ2(3x) δ TCR,其中40或44 kDa γ2(2x)链和55 kDa γ2(3x)链分别以外显子2的二聚体或三聚体为特征,并且与δ链非二硫键连接。γ2(2x) ‘外显子2区’可能含有EX2R(有一个N-糖基化位点)或EX2T(没有N-糖基化位点)。γ2(3x) ‘外显子2区’由EX2、EX2R和EX2T组成。Vγ9、Cγ1、Cγ2、Vδ1、Vδ2和Cδ结构域分别由TRGV9、TRGC1、TRGC2、TRDV1、TRDV2和TRDC基因编码。Vγ1结构域可以由3-5个功能TRGV1亚组基因中的任何一个编码。
### TCR-CD3复合体
**TCR-CD3复合体的构建**
除了αβ或γδ异源二聚体在结构上对每个T细胞克隆都是独一无二的,TCR-CD3复合体还包括额外的非多态CD3γ、CD3δ、CD3ε、CD3ζ和CD3η蛋白,这些蛋白在所有T细胞中都是相同的。CD3蛋白负责将TCR占位与细胞内信号转导通路偶联,从而导致T细胞激活。CD3γ、CD3δ和CD3ε链包含一个C2型N端Ig样胞外域、一个连接肽、一个跨膜区和一个胞质区(图2)(表1)。CD3ζ和CD3η缺乏Ig样结构域。CD3蛋白的跨膜区具有预测的α-螺旋构型,并含有带负电荷的氨基酸(CD3δ、CD3ε、CD3ζ和CD3η链的天冬氨酸,CD3γ链的谷氨酸)(表1)。CD3链的胞质区域比TCRα、β、γ和δ链的胞质区域要长得多,并且在与直接参与抗原结合信号转导的胞质成分的相互作用中起着重要作用。事实上,CD3蛋白的细胞质区域具有一个特征基序Yxx(L/I)x6-8Yxx(L/I),称为ITAM(基于免疫受体酪氨酸的激活基序)。CD3γ、CD3δ和CD3ε有一个ITAM,而CD3ζ和CD3η分别有3个和2个ITAMs(图2)(表1)。CD3ζ ITAMs的磷酸化导致携带ZAP-70(70 kDa的Zeta相关蛋白)等蛋白的SH2的募集。
**CD3γ, CD3δ, and CD3ε链**
人CD3γ (25 KDa)和CD3δ (20 KDa)是含有两个N连接的寡糖侧链的糖蛋白,蛋白质大小为16 kDa。CD3ε (20 KDa)不是糖基化的。这些链包含一个具有链内二硫键的类Ig结构域。分别编码γ、δ和ε链的CD3G、CD3D和CD3E基因位于人类染色体11q23的60kb范围内,可能是由基因复制引起的。CD3G和CD3D基因高度同源,位于1.5kb以内。T细胞的活化导致CD3γ和CD3δ的磷酸化。
**CD3ζ and CD3η链**
人CD3ζ链是一个16 kDa的非糖基化蛋白,与其他CD3或TCR链没有序列或结构上的同源性。与其他链相比,ζ有一个非常短的9个氨基酸的胞外区,绝大多数蛋白质(142个氨基酸中的112个氨基酸)存在于细胞质区域。至于其他的CD3链,跨膜区有一个带负电荷的氨基酸。ζ链由位于1号染色体1q22-q23的CD3Z基因编码。
在大多数受体中,ζ以二硫键连接的32 kDa(ζζ)同源二聚体形式存在。在37 kDa(ζη)的异源二聚体中,ζ的5%到20%与CD3η(CD3 eta)相连,CD3η是ζ的21 kDa剪接变体。注意的是,ζ链与FcεRI、FcγRI(CD64)和FcγRIII(CD16)的γ链相关,并可与CD16结合。细胞同时具有同源二聚体和异源二聚体,其同源二聚体和异源二聚体的比例为5:1~10:1。T细胞的活化导致CD3ζ和CD3η的酪氨酸磷酸化。
**TCR-CD3复合体的生物合成与组装**
T细胞不能识别抗原,除非TCR-CD3复合物被正确装配,并在细胞表面有效运输和表达编码TCR-CD3蛋白的基因在T细胞成熟阶段依次表达。CD3γ、CD3δ和CD3ε由最早可识别的胸腺细胞合成,但这些蛋白质仍留在细胞内。TCR组分的装配发生在内质网(ER)内,并在生物合成后不久开始。在内质网中,与26 kDa非糖基化蛋白CD3ω或TRAP (T细胞受体相关蛋白)存在短暂的非共价结合。在进一步成熟后,T细胞开始在前T细胞的细胞表面表达前T细胞受体,即pTα(前T细胞受体α链“替代物”)和TCR β链的异二聚体。合成TCR α链后,在内质网中组装完整的TCR受体,并在高尔基体中对TCR和CD3链的N-连接侧链进行糖基化加工。然后TCR-CD3复合物被转运到质膜。不完全的TCR从高尔基体被导向溶酶体,在那里它们被迅速降解,或者在内质网中保留很长一段时间。
**TCR-CD3复合体的激活**
TCR-CD3复合体通过参与近端src相关蛋白酪氨酸激酶(PTK),如p56lck和p59fyn来启动信号传导。p56lck与CD4和CD8共受体的结合使这些激酶接近TCR-CD3复合体。CD3和CD3胞浆区的CXCP基序介导与p56lck的结合。这种非共价相互作用需要在lck的N-末端有两个半胱氨酸。p561ck的活性受CD45的控制,CD45最初使p56lck的抑制部位去磷酸化。在αβ或γδ T细胞受体识别抗原后,CD3γ、CD3δ和CD3ε和CD3ζ链的ITAM酪氨酸被p56lck和p59fyn磷酸化,这是信号级联中最早的事件之一。ITAM中两个酪氨酸的磷酸化(二磷酸化)是信号传递所必需的,因为这是有效招募ZAP-70的串联SH2结构域所必需的。随后被p56lck磷酸化的ZAP-70导致ZAP-70激活,并导致ZAP-70介导的效应分子的重新募集和磷酸化,如适配器蛋白LAT(T细胞激活连接物)和SLP-76(含SH2结构域的76 kDa的白细胞蛋白),它们将免疫受体偶联到下游的信号通路。因此,这些接头蛋白将TCR连接到PLC-γ1、Grb-2/Sos和PI3K,导致钙和MAP(丝裂原激活蛋白)激酶通路的激活。
T细胞的活化导致膜重组,并与APC形成超分子激活簇(SMAC)或成熟的免疫突触。这种接触显示了TCR受体及其信号蛋白复合体的分离,并与脂筏的结合有关。这些筏子也被称为GEMs,富含糖鞘糖脂的微域,含有GPI(糖基磷脂酰肌醇)连接的蛋白质,src样酪氨酸激酶和其他通过饱和的酰链靶向筏子的蛋白质。SMAC的中心区域含有TCR-CD3复合体、CD4或CD8辅受体、CD28共刺激分子、CD2黏附分子、p56lck和p59fyn激酶、钙非依赖性蛋白激酶C(PKC)θ,而外围区域则富含LFA-1黏附分子和细胞骨架蛋白。TCR诱导的细胞骨架改变涉及通过SLP76-Vav-Nck信号来激活GTP酶Rho家族的效应器。CD45被排除在结扎的TCR附近。TCR和信号分子的分离似乎对淋巴细胞的激活至关重要。

